晶体的结合
晶体中原子的聚集是原子间相互作用的结果,这种使原子发生聚集的强烈的相互作用就是化学键。考虑波恩近似,一个两原子体系的能量为:
其中,$E_R$是电子的能量。在两原子相互靠近时,不仅会受到核间的库伦斥力,价电子的重新排布也会影响作用力$-\dfrac{\partial E(R)}{\partial R}$。价电子的重新分布情况取决于原子本身束缚电子的能力,所以,我们以下首先介绍原子本身束缚电子的能力——电负性。
原子的负电性
Mulliken考虑使用原子的电离能(ionization energy)和电子亲和能(electron affinity)来定义原子的电负性:
其中,$I$是原子的电离能,$E_A$是原子的电子亲和能。$K_m$是一个常数,通常使得Li的电负性为1.0。除此之外,还有Pauling、Allen等人提出的电负性定义。
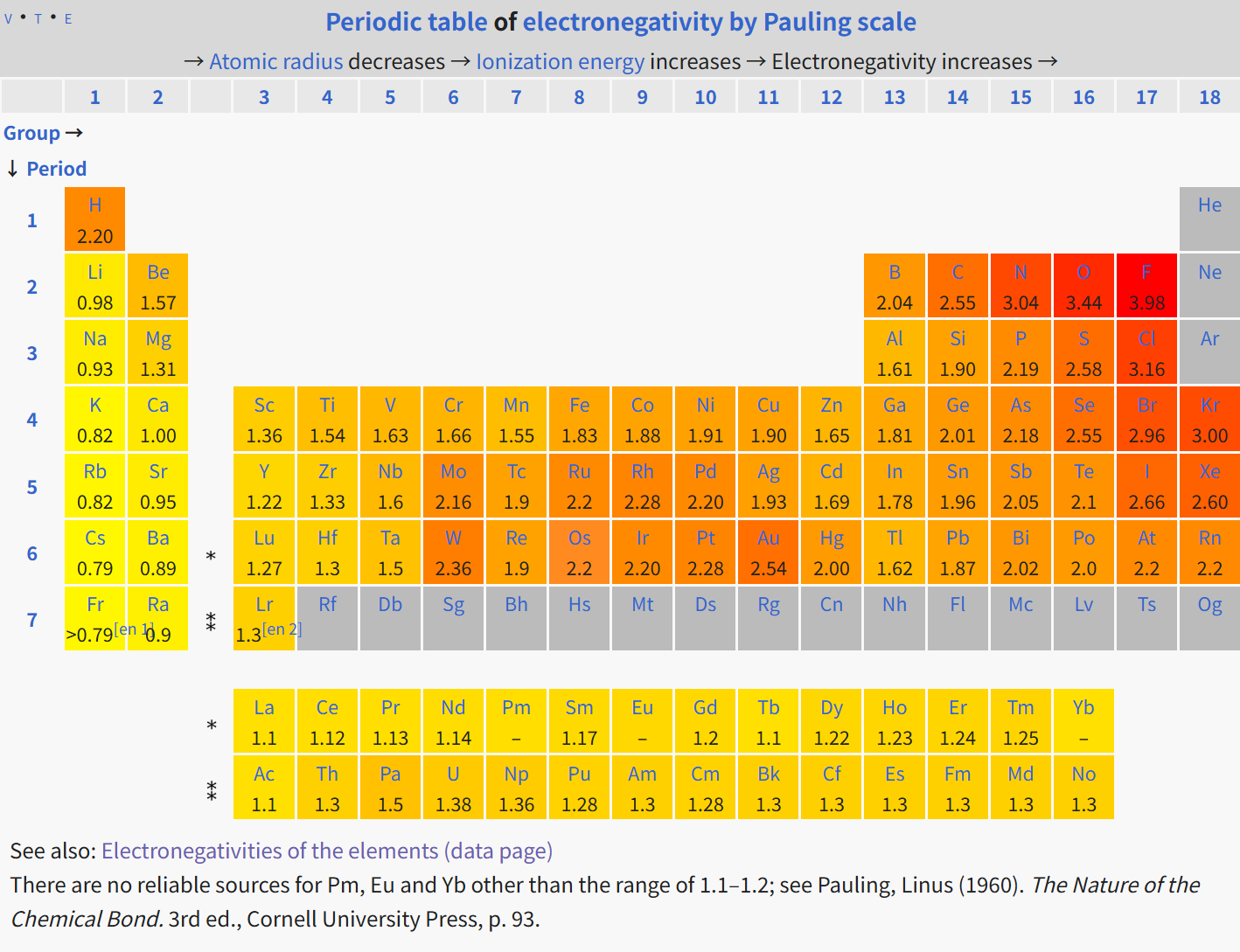
电离能定义为原子失去一个电子所需的能量。亲合能定义为原子获得一个电子所释放的能量。随着核电子数的增加,原子核正电的作用增加比外部电子层的平均负电作用快,导致同一周期内的原子电离能逐渐增大。
晶体结合的类型
金属键
金属原子对电子的束缚能力较弱,价电子进而呈现退局域化的特征,从而导致能量降低。用以下图像可以形象地理解金属键的形成。考虑若干无穷势阱中的电子,其能量为:
当无穷势阱间的壁垒被打破:
尽管由于泡利不相容原理,电子的能级会相应升高,其总能量会降低。
由于金属晶体中价电子的公有化,可以抽象为负电子云中的正电荷离子实系统。若金属的体积减小,电子云的密度增大,导致库伦能降低,同时电子云的动能会增大,二者的平衡决定了金属的体积。
共价键
对于负电性较强的元素,电子既不会像金属中退局域化那样自由移动,也不会像离子化合物中那样完全转移。相反,电子会在两个原子之间共享,形成共价键。共价键的形成伴随能量降低,可以用量子力学的全同粒子与交换力来理解。自旋反平行的态由于空间波函数对称,存在等效吸引力,可以存在与排斥力平衡的状态。
也可以理解为单态位于低势能区的概率密度要更大,所以能量更低。
考虑以下图像:两个无穷深势阱中的电子,其能量为:
如果两个无穷深势阱的壁垒被打破,对称态的能量为:
反对称态的能量为:
在 Approximation Method 中举得氢分子离子的例子可能更加具体。
sp3杂化
金刚石的基态原子组态为$1s^2 2s^2 2p^2$,为什么能形成四个共价键?这是因为在基态时,$2s$和$2p$轨道会发生杂化,形成四个未配对的电子$\phi_{2s},\phi_{2p_x},\phi_{2p_y},\phi_{2p_z}$,然后四个波函数重新组合为:
尽管杂化需要能量,但由于形成的四个共价键的能量更低,杂化是有利的。
离子键
当两个负电性差异很大的原子靠近时,电子会从负电性较弱的原子转移到负电性较强的原子上,形成离子键。离子键可以理解为极性共价键的极端情况。
范德瓦耳斯键
中性原子没有很强的相互作用力,但是量子涨落引起的瞬时电偶极矩会产生等效的吸引力。相比于其他类型的结合(一个电子伏特量级),范德瓦耳斯键的结合能较小,通常在0.1eV左右。
可以通过以下图像解释其六次方反比的吸引势。两组正负电荷分别通过弹簧耦合,中间相邻的为异种电荷。不考虑库伦相互作用,基态能量为:
考虑相互作用的哈密顿量:
其中,$x_1$和$x_2$是两组原子之间的距离,$r$是同种电荷之间的距离。通过泰勒展开,可以得到:
引入简正坐标:
振动能量变为:
本征能量为:
氢键
尽管氢拥有一个价电子,但由于第一电离能大于其他碱金属元素,很难形成离子键。在一定条件下,可以和电负性强的原子形成共价键,裸露的原子核再跟另一个原子形成氢键。
以水为例,氧$2s^2 2p^4$形成了不等性$sp^3$杂化,其中两个轨道为共价键,两个轨道跟氢原子形成氢键。氢键的结合能较小,通常在0.1eV左右。
混合键
以石墨为例,碳$2s^2 2p^2$形成了$sp^2$杂化,三个杂化波函数分别为:
剩下的一个$2p_z$电子则用于形成金属键,层间则形成范德瓦尔斯键。这可以解释石墨的导电性和层间的滑动性。
这里提一嘴杂化波函数的构造原则:
- 归一化:$|\Phi_i|^2=1$
- 正交性:$|\Phi_i\Phi_j|=\delta_{ij}$